La química orgánica es la química del elemento carbono. La química orgánica tiene una gran variedad de compuestos, esta variedad se debe a que el elemento carbono posee una propiedad de la concatenación, esto significa que el elemento carbono se puede unir con otros átomos de carbono formando cadenas carbonadas de diferentes longitudes.
miércoles, 17 de agosto de 2011
martes, 29 de marzo de 2011
Soluciones o Disoluciones
Una solución (o disolución) es una mezcla de dos o más componentes, perfectamente homogénea ya que cada componente se mezcla íntimamente con el otro, de modo tal que pierden sus características individuales. Esto último significa que los constituyentes son indistinguibles y el conjunto se presenta en una sola fase (sólida, líquida o gas) bien definida.
Una solución que contiene agua como solvente se llama solución acuosa.
Si se analiza una muestra de alguna solución puede apreciarse que en cualquier parte de ella su composición es constante.
Entonces, reiterando, llamaremos solución o disolución a las mezclas homogéneas que se encuentran en fase líquida. Es decir, las mezclas homogéneas que se presentan en fase sólida, como las aleaciones (acero, bronce, latón) o las que se hallan en fase gaseosa (aire, humo, etc.) no se les conoce como disoluciones.
Las mezclas de gases, tales como la atmósfera, a veces también se consideran como soluciones.

Las soluciones son distintas de los coloides y de las suspensiones en que las partículas del soluto son de tamaño molecular y están dispersas uniformemente entre las moléculas del solvente.
Las sales, los ácidos, y las bases se ionizan cuando se disuelven en el agua
Características de las soluciones (o disoluciones):
I) Sus componente no pueden separarse por métodos físicos simples como decantación, filtración, centrifugación, etc.
II) Sus componentes sólo pueden separase por destilación, cristalización, cromatografía.
III) Los componentes de una solución son soluto y solvente.
soluto es aquel componente que se encuentra en menor cantidad y es el que se disuelve. El soluto puede ser sólido, líquido o gas, como ocurre en las bebidas gaseosas, donde el dióxido de carbono se utiliza como gasificante de las bebidas. El azúcar se puede utilizar como un soluto disuelto en líquidos (agua).
solvente es aquel componente que se encuentra en mayor cantidad y es el medio que disuelve al soluto. El solvente es aquella fase en que se encuentra la solución. Aunque un solvente puede ser un gas, líquido o sólido, el solvente más común es el agua. (Ver: El agua como solvente).
IV) En una disolución, tanto el soluto como el solvente interactúan a nivel de sus componentes más pequeños (moléculas, iones). Esto explica el carácter homogéneo de las soluciones y la imposibilidad de separar sus componentes por métodos mecánicos.
Mayor o menor concentración
Ya dijimos que las disoluciones son mezclas de dos o más sustancias, por lo tanto se pueden mezclar agregando distintas cantidades: Para saber exactamente la cantidad de soluto y de solvente de una disolución se utiliza una magnitud denominada concentración.
Dependiendo de su concentración, las disoluciones se clasifican en diluidas, concentradas, saturadas, sobresaturadas.
Diluidas: si la cantidad de soluto respecto del solvente es pequeña. Ejemplo: una solución de 1 gramo de sal de mesa en 100 gramos de agua.
Concentradas: si la proporción de soluto con respecto del solvente es grande. Ejemplo: una disolución de 25 gramos de sal de mesa en 100 gramos de agua.
Saturadas: se dice que una disolución está saturada a una determinada temperatura cuando no admite más cantidad de soluto disuelto. Ejemplo: 36 gramos de sal de mesa en 100 gramos de agua a 20º C.
Si intentamos disolver 38 gramos de sal en 100 gramos de agua, sólo se disolvería 36 gramos y los 2 gramos restantes permanecerán en el fondo del vaso sin disolverse.
Sobresaturadas: disolución que contiene mayor cantidad de soluto que la permitida a una temperatura determinada. La sobresaturación se produce por enfriamientos rápidos o por descompresiones bruscas. Ejemplo: al sacar el corcho a una botella de refresco gaseoso.
Modo de expresar las concentraciones
Ya sabemos que la concentración de las soluciones es la cantidad de soluto contenido en una cantidad determinada de solvente o solución. También debemos aclarar que los términos diluida o concentrada expresan concentraciones relativas.
Las unidades de concentración en que se expresa una solución o disolución pueden clasificarse en unidades físicas y en unidades químicas.
Unidades físicas de concentración
Las unidades físicas de concentración están expresadas en función del peso y del volumen, en forma porcentual, y son las siguientes:
a) Tanto por ciento peso/peso %P/P = (cantidad de gramos de soluto) / (100 gramos de solución)
b) Tanto por ciento volumen/volumen %V/V = (cantidad de cc de soluto) / (100 cc de solución)
c) Tanto por ciento peso/volumen % P/V =(cantidad de gr de soluto)/ (100 cc de solución)
a) Porcentaje peso a peso (% P/P): indica el peso de soluto por cada 100 unidades de peso de la solució
Una solución que contiene agua como solvente se llama solución acuosa.
Si se analiza una muestra de alguna solución puede apreciarse que en cualquier parte de ella su composición es constante.
Entonces, reiterando, llamaremos solución o disolución a las mezclas homogéneas que se encuentran en fase líquida. Es decir, las mezclas homogéneas que se presentan en fase sólida, como las aleaciones (acero, bronce, latón) o las que se hallan en fase gaseosa (aire, humo, etc.) no se les conoce como disoluciones.
Las mezclas de gases, tales como la atmósfera, a veces también se consideran como soluciones.

Las soluciones son distintas de los coloides y de las suspensiones en que las partículas del soluto son de tamaño molecular y están dispersas uniformemente entre las moléculas del solvente.
Las sales, los ácidos, y las bases se ionizan cuando se disuelven en el agua
Características de las soluciones (o disoluciones):
I) Sus componente no pueden separarse por métodos físicos simples como decantación, filtración, centrifugación, etc.
II) Sus componentes sólo pueden separase por destilación, cristalización, cromatografía.
III) Los componentes de una solución son soluto y solvente.
soluto es aquel componente que se encuentra en menor cantidad y es el que se disuelve. El soluto puede ser sólido, líquido o gas, como ocurre en las bebidas gaseosas, donde el dióxido de carbono se utiliza como gasificante de las bebidas. El azúcar se puede utilizar como un soluto disuelto en líquidos (agua).
solvente es aquel componente que se encuentra en mayor cantidad y es el medio que disuelve al soluto. El solvente es aquella fase en que se encuentra la solución. Aunque un solvente puede ser un gas, líquido o sólido, el solvente más común es el agua. (Ver: El agua como solvente).
IV) En una disolución, tanto el soluto como el solvente interactúan a nivel de sus componentes más pequeños (moléculas, iones). Esto explica el carácter homogéneo de las soluciones y la imposibilidad de separar sus componentes por métodos mecánicos.
Mayor o menor concentración
Ya dijimos que las disoluciones son mezclas de dos o más sustancias, por lo tanto se pueden mezclar agregando distintas cantidades: Para saber exactamente la cantidad de soluto y de solvente de una disolución se utiliza una magnitud denominada concentración.
Dependiendo de su concentración, las disoluciones se clasifican en diluidas, concentradas, saturadas, sobresaturadas.
Diluidas: si la cantidad de soluto respecto del solvente es pequeña. Ejemplo: una solución de 1 gramo de sal de mesa en 100 gramos de agua.
Concentradas: si la proporción de soluto con respecto del solvente es grande. Ejemplo: una disolución de 25 gramos de sal de mesa en 100 gramos de agua.
Saturadas: se dice que una disolución está saturada a una determinada temperatura cuando no admite más cantidad de soluto disuelto. Ejemplo: 36 gramos de sal de mesa en 100 gramos de agua a 20º C.
Si intentamos disolver 38 gramos de sal en 100 gramos de agua, sólo se disolvería 36 gramos y los 2 gramos restantes permanecerán en el fondo del vaso sin disolverse.
Sobresaturadas: disolución que contiene mayor cantidad de soluto que la permitida a una temperatura determinada. La sobresaturación se produce por enfriamientos rápidos o por descompresiones bruscas. Ejemplo: al sacar el corcho a una botella de refresco gaseoso.
Modo de expresar las concentraciones
Ya sabemos que la concentración de las soluciones es la cantidad de soluto contenido en una cantidad determinada de solvente o solución. También debemos aclarar que los términos diluida o concentrada expresan concentraciones relativas.
Las unidades de concentración en que se expresa una solución o disolución pueden clasificarse en unidades físicas y en unidades químicas.
Unidades físicas de concentración
Las unidades físicas de concentración están expresadas en función del peso y del volumen, en forma porcentual, y son las siguientes:
a) Tanto por ciento peso/peso %P/P = (cantidad de gramos de soluto) / (100 gramos de solución)
b) Tanto por ciento volumen/volumen %V/V = (cantidad de cc de soluto) / (100 cc de solución)
c) Tanto por ciento peso/volumen % P/V =(cantidad de gr de soluto)/ (100 cc de solución)
a) Porcentaje peso a peso (% P/P): indica el peso de soluto por cada 100 unidades de peso de la solució
viernes, 2 de julio de 2010
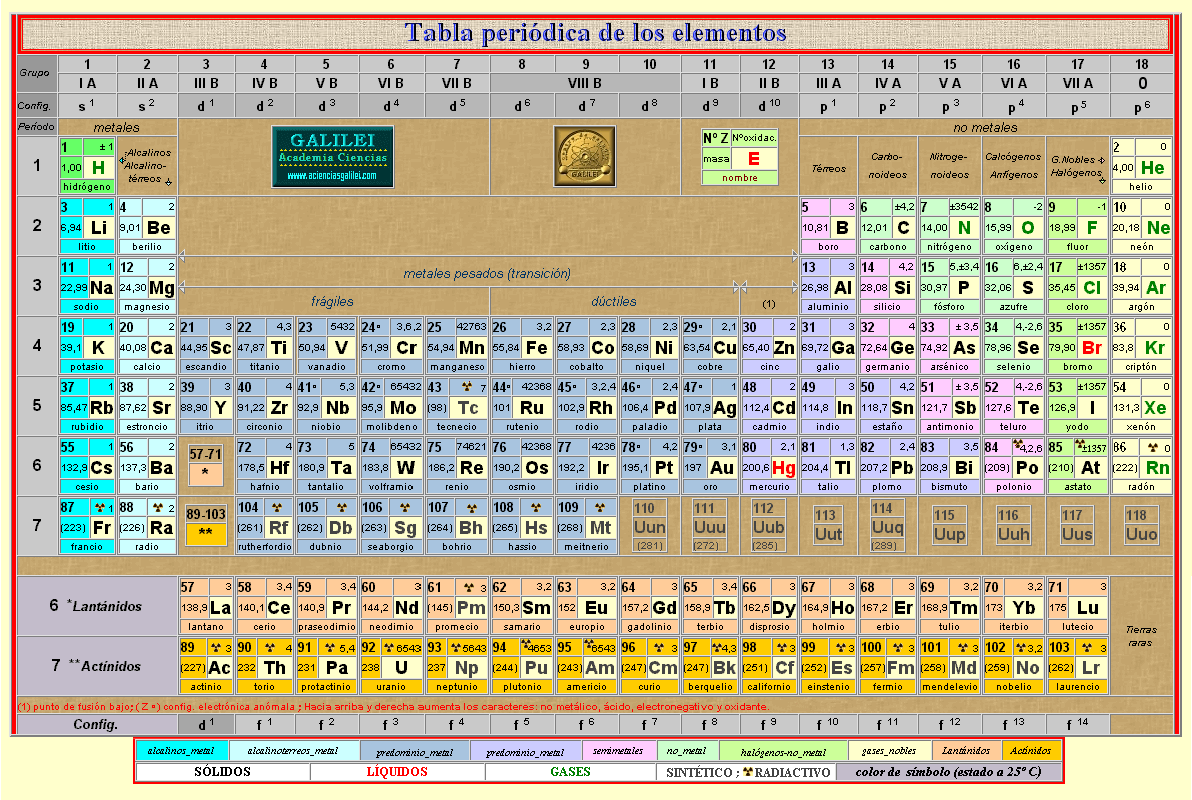
tabla periodica
Historia
La historia de la tabla periódica está íntimamente relacionada con varios aspectos del desarrollo de la química y la física:
* El descubrimiento de los elementos de la tabla periódica
* El estudio de las propiedades comunes y la clasificación de los elementos
* La noción de masa atómica (inicialmente denominada "peso atómico") y, posteriormente, ya en el siglo XX, de número atómico y
* Las relaciones entre la masa atómica (y, más adelante, el número atómico) y las propiedades periódicas de los elementos.
El descubrimiento de los elementos
Aunque algunos elementos como el oro (Au), plata (Ag), cobre (Cu), plomo (Pb) y el mercurio (Hg) ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en el siglo XVII cuando el alquimista Henning Brand descubrió el fósforo (P). En el siglo XVIII se conocieron numerosos nuevos elementos, los más importantes de los cuales fueron los gases, con el desarrollo de la química neumática: oxígeno (O), hidrógeno (H) y nitrógeno (N). También se consolidó en esos años la nueva concepción de elemento, que condujo a Antoine Lavoisier a escribir su famosa lista de sustancias simples, donde aparecían 33 elementos. A principios del siglo XIX, la aplicación de la pila eléctrica al estudio de fenómenos químicos condujo al descubrimiento de nuevos elementos, como los metales alcalinos y alcalino-térreos, sobre todo gracias a los trabajos de Humphry Davy. En 1830 ya se conocían 55 elementos. Posteriormente, a mediados del siglo XIX, con la invención del espectroscopio, se descubrieron nuevos elementos, muchos de ellos nombrados por el color de sus líneas espectrales características: cesio (Cs, del latín caesĭus, azul), talio (Tl, de tallo, por su color verde), rubidio (Rb, rojo), etc.
Metales, no metales y metaloides y metales de transición
La primera clasificación de elementos conocida fue propuesta por Antoine Lavoisier, quien propuso que los elementos se clasificaran en metales, no metales y metaloides o metales de transición. Aunque muy práctico y todavía funcional en la tabla periódica moderna, fue rechazada debido a que había muchas diferencias en las propiedades físicas como químicas.
Triadas de Döbereiner
Uno de los primeros intentos para agrupar los elementos de propiedades análogas y relacionarlo con los pesos atómicos se debe al químico alemán Johann Wolfgang Döbereiner(1780-1849) quien en 1817 puso de manifiesto el notable parecido que existía entre las propiedades de ciertos grupos de tres elementos, con una variación gradual del primero al último. Posteriormente (1827) señaló la existencia de otros grupos de tres elementos en los que se daba la misma relación (cloro, bromo y yodo; azufre, selenio y telurio; litio, sodio y potasio).
Triadas de Döbereiner Litio LiCl
LiOH Calcio CaCl2
CaSO4 Azufre H2S
SO2
Sodio NaCl
NaOH Estroncio SrCl2
SrSO4 Selenio H2Se
SeO2
Potasio KCl
KOH Bario BaCl2
BaSO4 Telurio H2Te
TeO2
A estos grupos de tres elementos se les denominó triadas y hacia 1850 ya se habían encontrado unas 20, lo que indicaba una cierta regularidad entre los elementos químicos.
Döbereiner intentó relacionar las propiedades químicas de estos elementos (y de sus compuestos) con los pesos atómicos, observando una gran analogía entre ellos, y una variación gradual del primero al último.
En su clasificación de las triadas (agrupación de tres elementos) Döbereiner explicaba que el peso atómico promedio de los pesos de los elementos extremos, es parecido al peso atómico del elemento de en medio. Por ejemplo, para la triada Cloro, Bromo, Yodo los pesos atómicos son respectivamente 36, 80 y 127; si sumamos 36 + 127 y dividimos entre dos, obtenemos 81, que es aproximadamente 80 y si le damos un vistazo a nuestra tabla periódica el elemento con el peso atómico aproximado a 80 es el bromo lo cual hace que concuerde un aparente ordenamiento de triadas.
Ley de las octavas de Newlands
En 1864, el químico inglés John Alexander Reina Newlands comunicó al Royal College of Chemistry (Real Colegio de Química) su observación de que al ordenar los elementos en orden creciente de sus pesos atómicos (prescindiendo del hidrógeno), el octavo elemento a partir de cualquier otro tenía unas propiedades muy similares al primero. En esta época, los llamados gases nobles no habían sido aún descubiertos.
Ley de las octavas de Newlands 1 2 3 4 5 6 7
Li
6,9
Na
23,0
K
39,0 Be
9,0
Mg
24,3
Ca
40,0 B
10,8
Al
27,0
C
12,0
Si
28,1
N
14,0
P
31,0
O
16,0
S
32,1
F
19,0
Cl
35,5
Esta ley mostraba una cierta ordenación de los elementos en familias (grupos), con propiedades muy parecidas entre sí y en Periodos, formados por ocho elementos cuyas propiedades iban variando progresivamente.
El nombre de octavas se basa en la intención de Newlands de relacionar estas propiedades con la que existe en la escala de las notas musicales, por lo que dio a su descubrimiento el nombre de ley de las octavas.
Como a partir del calcio dejaba de cumplirse esta regla, esta ordenación no fue apreciada por la comunidad científica que lo menospreció y ridiculizó, hasta que 23 años más tarde fue reconocido por la Royal Society, que concedió a Newlands su más alta condecoración, la medalla Davy.
Tabla periódica de Mendeléyev
Artículo principal: Tabla periódica de Mendeléyev
En 1869, el ruso Dmitri Ivánovich Mendeleiev publica su primera Tabla Periódica en Alemania. Un año después lo hace Julius Lothar Meyer, que basó su clasificación periódica en la periodicidad de los volúmenes atómicos en función de la masa atómica de los elementos.
Por ésta fecha ya eran conocidos 63 elementos de los 90 que existen en la naturaleza. La clasificación la llevaron a cabo los dos químicos de acuerdo con los criterios siguientes:
* Colocaron los elementos por orden creciente de sus masas atómicas.
* Situaron en el mismo grupo elementos que tenían propiedades comunes como la valencia.
Tabla de Mendeléyev publicada en 1872. En ella deja casillas libres para elementos por descubrir.
La primera clasificación periódica de Mendeléyev no tuvo buena acogida al principio. Después de varias modificaciones publicó en el año 1872 una nueva Tabla Periódica constituida por ocho columnas desdobladas en dos grupos cada una, que al cabo de los años se llamaron familia A y B.
En su nueva tabla consigna las fórmulas generales de los hidruros y óxidos de cada grupo y por tanto, implícitamente, las valencias de esos elementos.
Esta tabla fue completada a finales del siglo XIX con un grupo más, el grupo cero, constituido por los gas noble descubiertos durante esos años en el aire. El químico ruso no aceptó en principio tal descubrimiento, ya que esos elementos no tenían cabida en su tabla. Pero cuando, debido a su inactividad química (valencia cero), se les asignó el grupo cero, la Tabla Periódica quedó más completa.
El gran mérito de Mendeléyev consistió en pronosticar la existencia de elementos. Dejó casillas vacías para situar en ellas los elementos cuyo descubrimiento se realizaría años después. Incluso pronosticó las propiedades de algunos de ellos: el galio (Ga), al que llamó eka-aluminio por estar situado debajo del aluminio; el germanio (Ge), al que llamó eka-sicilio; el escandio (Sc); y el tecnecio (Tc), que sería el primer elemento artificial obtenido en el laboratorio, por síntesis química, en 1937.
La historia de la tabla periódica está íntimamente relacionada con varios aspectos del desarrollo de la química y la física:
* El descubrimiento de los elementos de la tabla periódica
* El estudio de las propiedades comunes y la clasificación de los elementos
* La noción de masa atómica (inicialmente denominada "peso atómico") y, posteriormente, ya en el siglo XX, de número atómico y
* Las relaciones entre la masa atómica (y, más adelante, el número atómico) y las propiedades periódicas de los elementos.
El descubrimiento de los elementos
Aunque algunos elementos como el oro (Au), plata (Ag), cobre (Cu), plomo (Pb) y el mercurio (Hg) ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en el siglo XVII cuando el alquimista Henning Brand descubrió el fósforo (P). En el siglo XVIII se conocieron numerosos nuevos elementos, los más importantes de los cuales fueron los gases, con el desarrollo de la química neumática: oxígeno (O), hidrógeno (H) y nitrógeno (N). También se consolidó en esos años la nueva concepción de elemento, que condujo a Antoine Lavoisier a escribir su famosa lista de sustancias simples, donde aparecían 33 elementos. A principios del siglo XIX, la aplicación de la pila eléctrica al estudio de fenómenos químicos condujo al descubrimiento de nuevos elementos, como los metales alcalinos y alcalino-térreos, sobre todo gracias a los trabajos de Humphry Davy. En 1830 ya se conocían 55 elementos. Posteriormente, a mediados del siglo XIX, con la invención del espectroscopio, se descubrieron nuevos elementos, muchos de ellos nombrados por el color de sus líneas espectrales características: cesio (Cs, del latín caesĭus, azul), talio (Tl, de tallo, por su color verde), rubidio (Rb, rojo), etc.
Metales, no metales y metaloides y metales de transición
La primera clasificación de elementos conocida fue propuesta por Antoine Lavoisier, quien propuso que los elementos se clasificaran en metales, no metales y metaloides o metales de transición. Aunque muy práctico y todavía funcional en la tabla periódica moderna, fue rechazada debido a que había muchas diferencias en las propiedades físicas como químicas.
Triadas de Döbereiner
Uno de los primeros intentos para agrupar los elementos de propiedades análogas y relacionarlo con los pesos atómicos se debe al químico alemán Johann Wolfgang Döbereiner(1780-1849) quien en 1817 puso de manifiesto el notable parecido que existía entre las propiedades de ciertos grupos de tres elementos, con una variación gradual del primero al último. Posteriormente (1827) señaló la existencia de otros grupos de tres elementos en los que se daba la misma relación (cloro, bromo y yodo; azufre, selenio y telurio; litio, sodio y potasio).
Triadas de Döbereiner Litio LiCl
LiOH Calcio CaCl2
CaSO4 Azufre H2S
SO2
Sodio NaCl
NaOH Estroncio SrCl2
SrSO4 Selenio H2Se
SeO2
Potasio KCl
KOH Bario BaCl2
BaSO4 Telurio H2Te
TeO2
A estos grupos de tres elementos se les denominó triadas y hacia 1850 ya se habían encontrado unas 20, lo que indicaba una cierta regularidad entre los elementos químicos.
Döbereiner intentó relacionar las propiedades químicas de estos elementos (y de sus compuestos) con los pesos atómicos, observando una gran analogía entre ellos, y una variación gradual del primero al último.
En su clasificación de las triadas (agrupación de tres elementos) Döbereiner explicaba que el peso atómico promedio de los pesos de los elementos extremos, es parecido al peso atómico del elemento de en medio. Por ejemplo, para la triada Cloro, Bromo, Yodo los pesos atómicos son respectivamente 36, 80 y 127; si sumamos 36 + 127 y dividimos entre dos, obtenemos 81, que es aproximadamente 80 y si le damos un vistazo a nuestra tabla periódica el elemento con el peso atómico aproximado a 80 es el bromo lo cual hace que concuerde un aparente ordenamiento de triadas.
Ley de las octavas de Newlands
En 1864, el químico inglés John Alexander Reina Newlands comunicó al Royal College of Chemistry (Real Colegio de Química) su observación de que al ordenar los elementos en orden creciente de sus pesos atómicos (prescindiendo del hidrógeno), el octavo elemento a partir de cualquier otro tenía unas propiedades muy similares al primero. En esta época, los llamados gases nobles no habían sido aún descubiertos.
Ley de las octavas de Newlands 1 2 3 4 5 6 7
Li
6,9
Na
23,0
K
39,0 Be
9,0
Mg
24,3
Ca
40,0 B
10,8
Al
27,0
C
12,0
Si
28,1
N
14,0
P
31,0
O
16,0
S
32,1
F
19,0
Cl
35,5
Esta ley mostraba una cierta ordenación de los elementos en familias (grupos), con propiedades muy parecidas entre sí y en Periodos, formados por ocho elementos cuyas propiedades iban variando progresivamente.
El nombre de octavas se basa en la intención de Newlands de relacionar estas propiedades con la que existe en la escala de las notas musicales, por lo que dio a su descubrimiento el nombre de ley de las octavas.
Como a partir del calcio dejaba de cumplirse esta regla, esta ordenación no fue apreciada por la comunidad científica que lo menospreció y ridiculizó, hasta que 23 años más tarde fue reconocido por la Royal Society, que concedió a Newlands su más alta condecoración, la medalla Davy.
Tabla periódica de Mendeléyev
Artículo principal: Tabla periódica de Mendeléyev
En 1869, el ruso Dmitri Ivánovich Mendeleiev publica su primera Tabla Periódica en Alemania. Un año después lo hace Julius Lothar Meyer, que basó su clasificación periódica en la periodicidad de los volúmenes atómicos en función de la masa atómica de los elementos.
Por ésta fecha ya eran conocidos 63 elementos de los 90 que existen en la naturaleza. La clasificación la llevaron a cabo los dos químicos de acuerdo con los criterios siguientes:
* Colocaron los elementos por orden creciente de sus masas atómicas.
* Situaron en el mismo grupo elementos que tenían propiedades comunes como la valencia.
Tabla de Mendeléyev publicada en 1872. En ella deja casillas libres para elementos por descubrir.
La primera clasificación periódica de Mendeléyev no tuvo buena acogida al principio. Después de varias modificaciones publicó en el año 1872 una nueva Tabla Periódica constituida por ocho columnas desdobladas en dos grupos cada una, que al cabo de los años se llamaron familia A y B.
En su nueva tabla consigna las fórmulas generales de los hidruros y óxidos de cada grupo y por tanto, implícitamente, las valencias de esos elementos.
Esta tabla fue completada a finales del siglo XIX con un grupo más, el grupo cero, constituido por los gas noble descubiertos durante esos años en el aire. El químico ruso no aceptó en principio tal descubrimiento, ya que esos elementos no tenían cabida en su tabla. Pero cuando, debido a su inactividad química (valencia cero), se les asignó el grupo cero, la Tabla Periódica quedó más completa.
El gran mérito de Mendeléyev consistió en pronosticar la existencia de elementos. Dejó casillas vacías para situar en ellas los elementos cuyo descubrimiento se realizaría años después. Incluso pronosticó las propiedades de algunos de ellos: el galio (Ga), al que llamó eka-aluminio por estar situado debajo del aluminio; el germanio (Ge), al que llamó eka-sicilio; el escandio (Sc); y el tecnecio (Tc), que sería el primer elemento artificial obtenido en el laboratorio, por síntesis química, en 1937.
viernes, 7 de mayo de 2010
Agua
El agua es un compuesto químico presente en grandes cantidades en la Tierra, en estado liquido, sólido o gaseoso.
agua001
El agua es un compuesto de hidrógeno y oxigeno, su formula química, H2O, indica que cada molécula de agua contiene dos átomos de hidrógeno y uno de oxígeno.
El agua, a pesar de ser un líquido incoloro, inodoro e insípido, es en realidad una sustancia química de reacciones esenciales para la vida.
A la presión atmosférica (760 mm de mercurio), el punto de congelación del agua es de 0° C y su punto de ebullición de 100° C.
El agua es uno de los agentes ionizantes más conocidos. Puesto que todas las sustancias son de alguna manera solubles en agua, se la conoce frecuentemente como el disolvente universal. El agua combina con ciertas sales para formar hidratos, reacciona con los óxidos de los metales formando ácidos y actúa como catalizador en muchas reacciones químicas importantes.
Propiedades bioquímicas
Los seres vivos se han adaptado para utilizar químicamente el agua en dos tipos de reacciones:
• En la fotosíntesis en la que los enzimas utilizan el agua como fuente de átomos de hidrógeno.
• En las reacciones de hidrólisis, en que las enzimas hidrolíticas han explotado la capacidad del agua para romper determinados enlaces hasta degradar los compuestos orgánicos en otros más simples, durante los procesos digestivos.
agua002
Propiedades físico-químicas
El agua presenta las siguientes propiedades físico-químicas:
• Acción disolvente.
El agua es el líquido que más sustancias disuelve (disolvente universal), esta propiedad se debe a su capacidad para formar puentes de hidrógeno con otras sustancias, ya que estas se disuelven cuando interaccionan con las moléculas polares del agua.
La capacidad disolvente es la responsable de dos funciones importantes para los seres vivos: es el medio en que transcurren la mayoría de las reacciones del metabolismo, y el aporte de nutrientes y la eliminación de desechos se realizan a través de sistemas de transporte acuoso.
• Fuerza de cohesión entre sus moléculas.
Los puentes de hidrógeno mantienen a las moléculas fuertemente unidas, formando una estructura compacta que la convierte en un líquido casi incompresible.
• Elevada fuerza de adhesión.
De nuevo los puentes de hidrógeno del agua son los responsables, al establecerse entre estos y otras moléculas polares, y es responsable, junto con la cohesión, de la capilaridad, a la cual se debe, en parte, la ascensión de la sabia bruta desde las raíces hasta las hojas.
• Gran calor específico.
agua003
• Elevado calor de vaporización.
• Elevada constante dieléctrica.
Las moléculas de agua, al ser polares, se disponen alrededor de los grupos polares del soluto, llegando a desdoblar los compuestos iónicos en aniones y cationes, que quedan así rodeados por moléculas de agua. Este fenómeno se llama solvatación iónica.
• Bajo grado de ionización.
El agua pura tiene la capacidad de disociarse en iones, por lo que en realidad se puede considerar una mezcla de:
agua molecular (H2O )
protones hidratados (H3O+ ) e
iones hidroxilo (OH-)
agua005
De cada 107 moléculas de agua, sólo una se encuentra ionizada. H2O pO+ + OH-
Esto explica que la concentración de iones hidronio (pO+) y de los iones hidroxilo (OH-) sea muy baja. Dados los bajos niveles de pO+ y de OH-, si al agua se le añade un ácido o una base, aunque sea en poca cantidad, estos niveles varían bruscamente. (Ver más sobre Agua: Propiedades y funciones)
agua008
Electrólisis del agua
Al pasar electricidad por agua (H2O), se forma gas hidrógeno en el cátodo y oxígeno en el ánodo, como el agua contiene dos átomos de hidrógeno por cada uno de oxígeno, se produce el doble de hidrógeno que oxígeno, se divide así el compuesto en dos partes.
Ver: www2.uni-siegen.de/.../spanish/v21-2.html y Ver, también: Agua oxigenada)
Cuidado del agua
El agua constituye, por sus propiedades, una sustancia sumamente útil para ciertos procesos industriales, al igual que como medio de saneamiento de las ciudades y de limpieza en general.
Tratamientos químicos:
Suscribirse a:
Entradas (Atom)
